国家药监局:这30个药,可直接申请上市
日期:2019/5/11
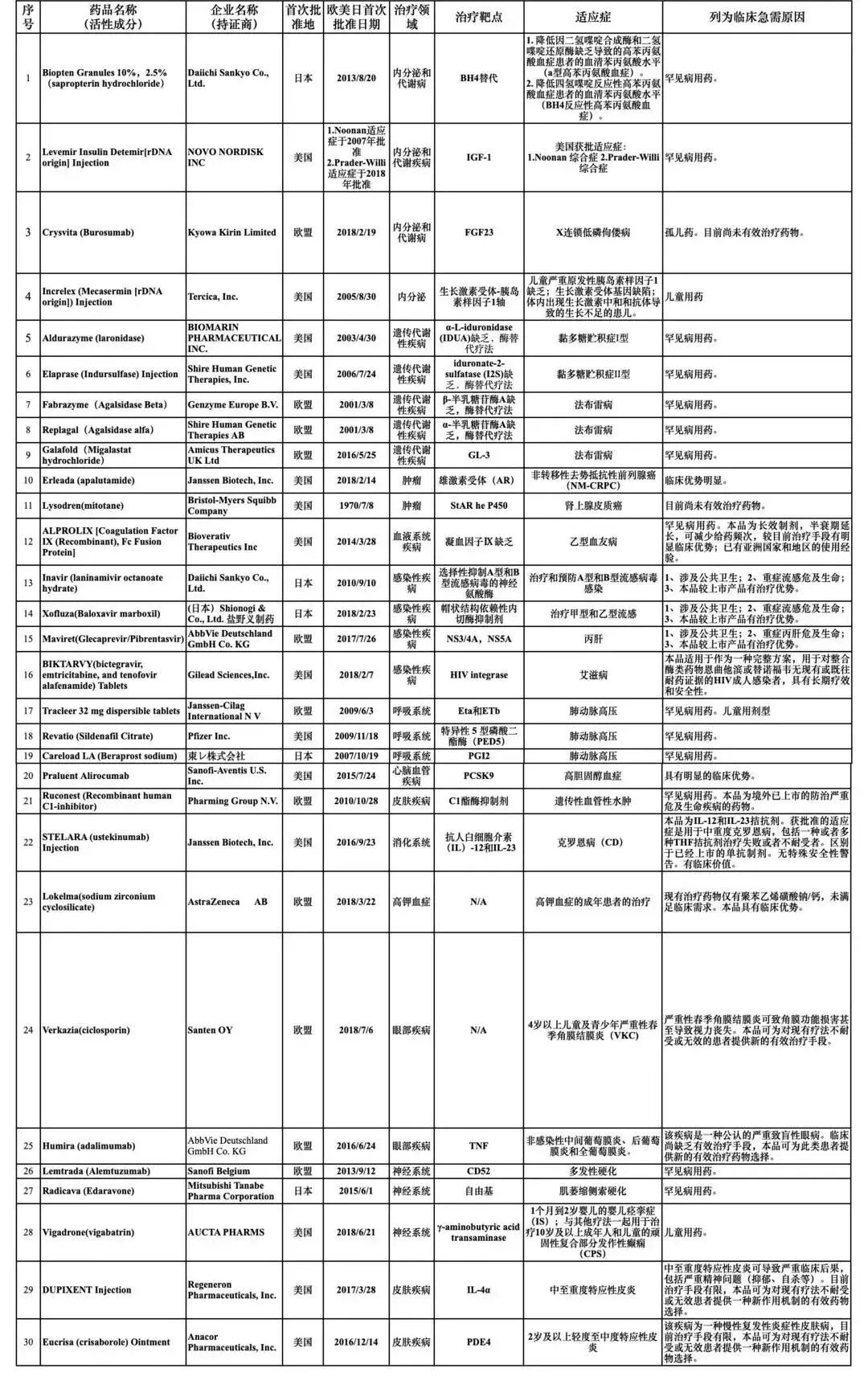
近日,国家药监局药品审评中心(下简称药审中心)发布《关于第二批临床急需境外新药的公示》,共涉及22家药企的30个药品。

这些药,越来越受关注
根据通知,此次名单中的30种药品中,首次批准地集中在欧盟、美国和日本。其中,14种药品为罕见病用药,包括治疗法布雷病(Fabry)的Fabrazyme(Agalsidase Beta),治疗肺动脉高压的Revatio(Sildenafil Citrate)、治疗肌萎缩侧索硬化(ALS,俗称“渐冻人症”)的Radicava (Edaravone)等。
这是药审中心在短短的五个月内,第二次发布临床急需境外新药。早在2018年11月1日,药审中心就曾发布了第一批临床急需境外新药名单,共有48个药品。其中,罕见病用药共有23个品种在列。
罕见病,是指那些发病率极低的疾病,称“孤儿病”,根据世界卫生组织(WHO)的定义,罕见病为患病人数占总人口的0.65%~1%的疾病。
据了解,截至目前,美国FDA批准的罕见病药物中,有259种在我国未上市。
从第一批、第二批名单,以及2018年以出台的政策来看,目前罕见病用药在我国越来越受关注。
2018年5月,国家卫健委等5部委联合发布的《第一批罕见病目录》,将肌萎缩侧索硬化、白化病、戈谢病等121种罕见病纳入其中,并于2019年2月27日发布《罕见病诊疗指南》,对121种罕见病进行系统的梳理,提供给各级临床医务人员学习和规范罕见病诊疗。
根据国家药监局2018年10月23日出台的《临床急需境外新药审评审批工作程序》,在审评方面,药审中心将建立专门通道开展审评,对罕见病治疗药品,在受理后3个月内完成技术审评;对其他境外新药,在受理后6个月内完成技术审评。
壹基金官网显示,截至2018年12月,《第一批罕见病目录》中共有74种罕见病是“有药可治的”,且这74种罕见病已在美国或欧盟、日本上市162种治疗药物,但其中仅有83种在中国上市,涉及53种罕见病。
然而,在中国明确注册罕见病适应症的药物仅有55种,涉及31种罕见病。在这55种药物中,仅有36种药物涉及23种罕见病已被纳入医保目录。
随着一系列政策落地,那些在发达国家获批上市,具有明确疗效的罕见病用药,将越来越多的被引进中国,填补市场空白。
下一个风口,经典药物新用
一个新药的发现,需要承担高额的投入和未知的风险,据统计,研发新药并成功上市需耗时13~15年,平均花费20亿~30亿美元,而随着对药物安全性及有效性的要求不断提高,开发新药的成本还将持续上涨。
由于罕见病患者人数少,加上治疗药物研发周期和成本都较一般药物高,药企大多动力不足,目前全球只有极少数的罕见病拥有有效治疗药物。
药物研发成本高企,对每个病人来说,需要承担的药费就更高。
在今年“两会”上,全国政协委员、香港食物及卫生局原局长高永文提到,在香港,罕见病病人一年的药费可能高达几百万元。
此前有媒体曾报道,患者一旦被确诊患上罕见病后,多年攒下的积蓄很快化作一粒粒药丸。在罕见病的药物尚未纳入医保时,一天能吃掉一部iPhone6。
据健康报报道,目前全球预计有超过3亿罕见病患者,中国有1680 多万人。已经明确的罕见病有7000 多种,其中80%为遗传病,如白化病、血友病等,95%的罕见病仍没有特效药。国外著名罕见病慈善机构Findacure介绍,如果按照现在的药物发展速度,让罕见病患者用上创新药需要等500年。
因此,国际罕见病慈善机构已联合发起了“罕见病经典药物新用的公开呼吁”。
相比新药而言,经典药物由于药动学以及安全性资料较为详尽,对其新用途的开发能很快进入Ⅱ期临床评估,使研发周期缩短至3~12年。
事实上,临床上也有不少经典药物被研究成为“新药”的例子。
例如,有着百年历史的阿司匹林,其适应症由最初的解热镇痛,逐渐扩展到偏头痛、抗血栓等;
达泊西汀最初主要作为镇痛和抗抑郁药物,却在2009年被美国FDA批准用于治疗早泄,成为治疗早泄的第一款口服药物;
导致海豹肢的沙利度胺,最初的适应症是治疗孕吐,随着不断的研究,在1998年被美国FDA批准沙利度胺治疗麻风结节性红斑的治疗,在2006年再被批准用于治疗多发性骨髓瘤。
这样的例子还有很多。而在罕见病用药方面,也已有类似的尝试。
位列于本次国家药监局公布的《第二批临床急需境外新药》,治疗ALS(“渐冻人症”)的Edaravone(依达拉奉),此前其实是脑卒中的经典治疗药物。
依达拉奉是日本三菱制药公司研制的新药,2001年上市后迅速成为脑卒中治疗的一线药物。并受到日本脑卒中诊治指南推荐使用。2015年该产品在日本获批ALS新适应症。2017年5月,美国FDA批准了依达拉奉作为“渐冻人症”治疗药物上市销售,这是继利鲁唑后,唯一获批治疗该疾病药物。
截至目前,依达拉奉已经先后在日本、韩国、美国、加拿大四个国家获批用于ALS的新适应症。类似的经典药物新用,特别是在罕见病领域,正在越来越受到重视。
据了解,依达拉奉于2004年在中国上市,作为脑卒中治疗药物已被写入国内相关指南,并纳入医保范围,且相较于利鲁唑的高自费价格,能减轻患者负担。因此,业内专家对依达拉奉在国内治疗ALS的前景持乐观态度。
随着罕见病用药相关政策逐渐落地,临床研究的不断深入,罕见病领域的经典药物新用,将有望成为下一个风口。
附:临床急需境外新药名单(第二批)
(点击放大查看)
BY/
来源:赛柏蓝
|