以岭药业两抗癌药获FDA批文,是否有意“弯道超车”?
日期:2018/11/24
【云端导读】
以岭药业两产品相继获得FDA审批通过,分别是阿那曲唑片和来曲唑片,其适应症同为乳腺癌治疗。本次获得FDA批文,标志着其具备在美国市场销售该产品的资格,对其拓展美国市场带来积极影响。而以岭是否有意借海外共线产品这条“捷径”来实现通过一致性评价,目前还只是猜测。

11月17日,以岭药业发表公告,其全资孙公司制剂产品来曲唑片获得美国FDA批准文号,而前两天,11月15日,以岭孙公司的另一制剂产品阿那曲唑片也已获得美国FDA审批。两天时间以岭药业有两个制剂产品相继获得FDA审批通过,且适应症同为用于乳腺癌治疗。
以下为该两品种的具体信息:
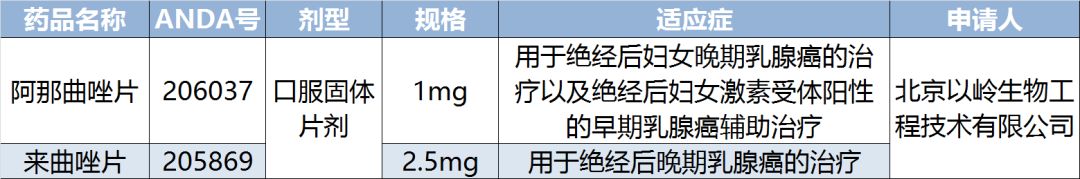
关于阿那曲唑片:
阿那曲唑片适用于绝经后妇女晚期乳腺癌的治疗以及绝经后妇女激素受体阳性的早期乳腺癌辅助治疗。阿那曲唑片由ANIPHARMACEUTICALSINC研发,于1995年在美国获批上市。
当前,美国市场阿那曲唑片主要生产商为ACCORDHEALTHCARE和TEVAPHARMACEUTICA、BLUEPOINTLABS等。IMS数据显示,2017年6月-2018年6月阿那曲唑片1mg美国市场销售额约1577万美元。截至目前,该企业在阿那曲唑片研发项目上已投入研发费用294万元人民币。
关于来曲唑片:
来曲唑片用于绝经后晚期乳腺癌的治疗。来曲唑能有效抑制雄激素向雌激素转化,选择性较高,具有较高的治疗指数。与其他芳香化酶抑制剂和抗雌激素药物相比,来曲唑的抗肿瘤作用更强。来曲唑片由NOVARTISPHARMACEUTICALSCORP(诺华)研发,于1997年在美国获批上市。
当前,美国市场来曲唑片主要生产商为ACCORDHEALTHCARE和TEVAPHARMACEUTICA、BRECKENRIDGE等。IMS数据显示,2017年7月-2018年6月来曲唑片2.5mg美国市场销售额约1622万美元。截至目前,该企业在来曲唑片研发项目上已投入研发费用251万元人民币。
本次阿那曲唑片和来曲唑片两个产品获得美国FDA批准文号,标志着北京以岭生物工程技术有限公司具备了在美国市场销售该产品的资格,将对其拓展美国市场带来积极的影响。企业将积极推动该产品在美国市场的上市准备。
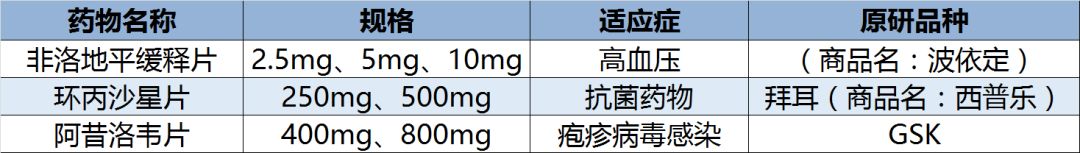
目前以岭药业已有5个制剂产品获得FDA批文:
据悉,此前,以岭药业在今年10月、6月和3月还有三个制剂产品获得美国FDA的批文:抗菌药物的环丙沙星片以及疱疹病毒感染药物的阿昔洛韦片。
以岭药业作为一个以专利中药为基础的特色企业,近年来也开始积极布局化药产业,构建专利中药和化药两方面协同发展、相互促进的产业格局。
据企业公告信息显示,在化药仿制药业务方面,目前该企业已向FDA递交了九个ANDA申请,其中以上三个制剂产品以通过审批获得美国上市资格,部分产品已成功销往美国市场;同时多个化学一类新药的研发工作。
另外,在合同加工业务方面,以岭药业是国内出口制剂规范市场规模较大的企业之一,产品已出口至英国、加拿大、新西兰、德国、澳大利亚等多个国家和地区。
近年来鉴于国家对中药产品的监管趋严,相关企业已感受到政策带来的压力,开拓多方面产品协调发展成为其谋求发展的有效出路。
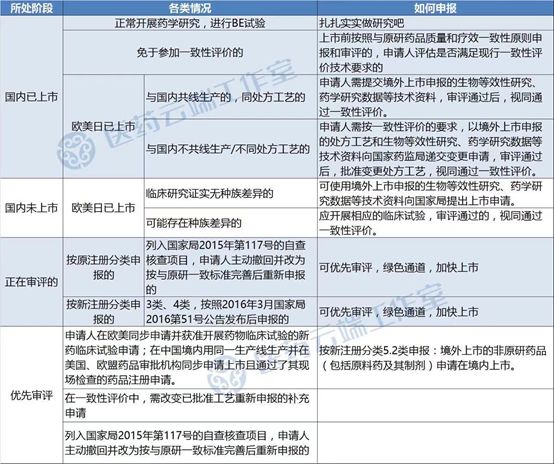
而从另一个角度考虑,以岭药业如此积极斩获FDA文号,是否有意借欧美获准上市的制剂产品走海外共线生产这条“捷径”实现“弯道超车”,来通过通过一致性评价?目前还只是猜测,毕竟上述五个品种目前尚无厂家通过一致性评价。
通过一致性评价的“四条捷径”
信息来源:医药云端工作室 |