尝到甜头后,22个品种申请上海MAH试点
日期:2018/11/24
【云端导读】
上海市药监局公布第三批已申请参加MAH试点的品种名单,涉及22个品种,包括上海医药集团申请的溴吡斯的明及片和卡马西平片;上海复星的美洛昔康片等。不久前(10月26日),第十三届人大六次会议决定:授权国务院在部分地方开展MAH制度试点工作的三年期限延长一年,并自2018年11月5日起施行。


11月13日,上海市药监局公布第三批已申请参加药品上市许可持有人制度改革试点品种名单,涉及22个品种,包括上海医药集团申请的溴吡斯的明及片和卡马西平片;上海复星的美洛昔康片;扬子江药业集团上海海尼药业的硼替佐米及注射液和注射用比伐芦定;再鼎医药的ZL-2401对甲苯磺酸盐及制剂;上海安必生的阿托伐他汀钙片等。

MAH制度试点延长1年
不久前(10月26日),第十三届全国人民代表大会常务委员会第六次会议决定:将2015年11月4日第十二届全国人民代表大会常务委员会第十七次会议授权国务院在部分地方开展药品上市许可持有人制度试点工作的三年期限延长一年。本决定自2018年11月5日起施行。
MAH制度的缘起及意义:药品批文的产权革命
2015年11月,全国人大常委会授权国务院在北京、天津、河北、上海、江苏、浙江、福建、山东、广东、四川10个省市开展药品上市许可持有人制度试点。
2016年6月,国务院办公厅发布《关于印发药品上市许可持有人制度试点方案的通知》(以下简称《通知》),明确试点内容、试点品种范围、持有人条件、持有人义务与责任等。
根据《通知》,试点行政区域内的药品研发机构或者科研人员可以作为药品注册申请人,提交药物临床试验申请、药品上市申请,申请人取得药品上市许可及药品批准文号的,可以成为药品上市许可持有人。法律法规规定的药物临床试验和药品生产上市相关法律责任,由申请人和持有人相应承担。
这意味着不具备药品生产资质的科研机构、甚至自然人(科研工作者)都可能依法持有药品批文。
对于持有人不具备相应生产资质的,须委托试点行政区域内具备资质的药品生产企业生产批准上市的药品。持有人具备相应生产资质的,可以自行生产,也可以委托受托生产企业生产。这一规定,既解决了持有人的生产问题,也使得多点委托生产成为可能。
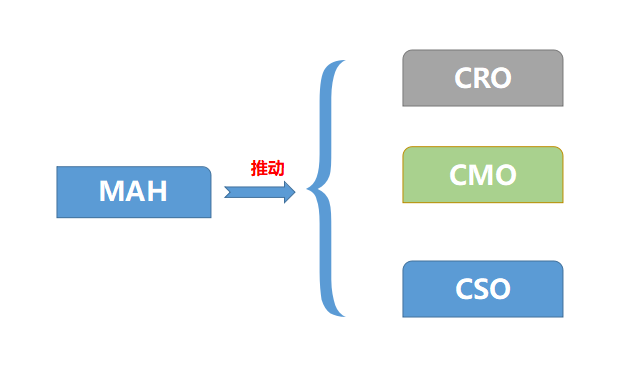
MAH制度推动医药外包服务CRO、CMO、CSO的蓬勃发展
上市许可持有人(MAH)制度最大的意义在于让医药市场要素灵活的流动,不具备药品经营生产和经营资质的机构和个人只要有创新能力,都可以持有药品批件,通过委托授权其他生产企业生产或销售经营企业来进行销售,而不是过去将批文绑定在生产企业,这也促进了医药服务外包的三种形式:上游发研发外包CRO、生产外包CMO、营销外包CSO。
国内已有企业获益
2016年12月27日,齐鲁制药有限公司研发的首仿药品吉非替尼经CFDA批准取得上市许可持有人文号,成为中国首个药品上市许可持有人制度(MAH)试点品种。
2017年3月27日,浙江医药股份有限公司的苹果酸奈诺沙星原料药及其胶囊剂(商品名太捷信)经CFDA批准取得了药品上市许可持有人文号,这是我国药品上市许可持有人制度试点实施以来,获批的首个创新药。
得益于MAH制度,原本不具备药品生产资质的上海安必生制药技术有限公司,继获得上海市第一个MAH产品批件后,2018年10月9日又获得了该市首张药品研发企业上市许可人营业执照,经营范围为“药品委托生产(详见药品上市许可持有人药品注册批件)” 。

MAH制度的实施,将是医药行业的一次产权革命,能够提高药品研发机构和科研人员创新积极性,促进医药产业供给侧改革,提升产品质量,抑制低水平生产企业重复建设。
|