未通过一致性评价将被注销批文?完全是误读!
日期:2018/11/17
【云端导读】
无论是国务院办公厅还是原国家食药监局的文件,均没有“通不过一致性评价的品种注销批文”的规定,至今也未发出正式文件修改或补充。
令人不安的新闻
今天(11月6日),江苏省人民政府网站转载《新华日报》的一篇文章在朋友圈引起了轩然大波,这篇文章的标题非常劲爆,也非常令人惊恐:《我省清理仿制药市场 不通过一致性评价将注销批文》。
如下面截图所示:
这篇文章显示,江苏省食药监局药品注册管理处处长王宗敏介绍说,为了将药效欠佳的仿制药逐出市场,国家要求在年底前对289种纳入基本药物目录的仿制药完成质量一致性评价,未通过评价的仿制药将被注销批准文号。
令人不安是有原因的
通不过一致性评价的品种就要被注销批文,这句充满结论性的判断句在当前一致性评价工作进入关键期显得非常敏感。
一方面,多省已经对不通过评价品种暂停采购的通知,的确有一些品种因而退出市场;另一方面,289基药品种大限在即---离2018年12月31日已不足2个月,很多人对此悬着的一颗心,看到江苏省政府网站的这则报道后更加惶恐不安---江苏作为医药大省、医药强省有这样的规定,而且是省政府网站发出,难道还有假吗?
一时间,盆友圈刷屏,各个微信群议论纷纷,认为江苏下重手了,通不过的仿制药将遭遇灭顶之灾!恐怕下一步连江苏市场包括零售市场都进不去了!而且全国如此效法的话,不知有多少品种批文将要被省级药监部门注销!
误读的背后:没有理解一致性评价政策
然而,上述网站转载的内容及标题相当不严谨,甚至误读了国家一致性评价的政策,以至于误导了行业人士对政策的准确判断。作为专业的平台,医药云端工作室有必要对此事较较真。
事实上,对于一致性评价的退出机制,国务院办公厅及原国家食药监总局的两个重要文件说的很清楚。
2016年2月6日,《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)明确:
国家基本药物目录(2012年版)中2007年10月1日前批准上市的化学药品仿制药口服固体制剂,应在2018年底前完成一致性评价,其中需开展临床有效性试验和存在特殊情形的品种,应在2021年底前完成一致性评价;逾期未完成的,不予再注册。
化学药品新注册分类实施前批准上市的其他仿制药,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价;逾期未完成的,不予再注册。
以上文件将仿制药划分为3种情况并规定了时间限制,简而言之:
1、【289目录品种】国基520品种中2007年10月1日前批准上市的化学药品仿制药口服固体制剂(即289目录品种),应在2018年底前完成一致性评价;
2、【289目录中存在特殊情况的品种】最迟不能超过2021年底前完成评价;
3、【化学药品新注册分类实施前批准上市的其他仿制药】自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价;逾期未完成的,不予再注册。
请看,上述三种情况,虽然规定的“时间大限”及退出方式不同,但均没有提及注销药品批文的情况,更没有“不通过一致性评价就注销批文”的规定。
2016年5月25日,原国家食药监总局发布关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告(2016年第106号),该公告在退出方式上与国办发〔2016〕8号)略有不同,但行文表述上,同样没有注销批文的规定。
(二)凡2007年10月1日前批准上市的列入国家基本药物目录(2012年版)中的化学药品仿制药口服固体制剂(附件),原则上应在2018年底前完成一致性评价。
(三)上述第(二)款以外的化学药品仿制药口服固体制剂,企业可以自行组织一致性评价;自第一家品种通过一致性评价后,三年后不再受理其他药品生产企业相同品种的一致性评价申请。
CFDA与国办发〔2016〕8号)文件不同之处在于:
国办发〔2016〕8号):化学药品新注册分类实施前批准上市的其他仿制药,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价;逾期未完成的,不予再注册
CFDA2016年第106号文:上述第(二)款以外的化学药品仿制药口服固体制剂,企业可以自行组织一致性评价;自第一家品种通过一致性评价后,三年后不再受理其他药品生产企业相同品种的一致性评价申请。
对比两者文字可发现,CFDA文件与国务院文件显得较为宽松,三年时间到期只是“不再受理一致性评价申请”而已,并没有说后面怎么处理?没说不再注册,更没说注销批文。这样的表述在分析人士看来,也许为后面实在不能通过的品种留下了一条后路,或许,正因为如此,很多仿制药厂家对一致性评价工作不太积极,处于观望状态,估计这也是造成评价工作进展缓慢的原因之一。
综上所述,无论是国务院办公厅还是原国家食药监局的文件,均没有“通不过一致性评价的品种注销批文”的规定,至今也未发出正式文件修改或补充。
因此,结合江苏省政府转载的《新华日报》文章内容,我们认为这多半是媒体编辑不熟悉医药行业政策而曲解了之故,不值得大肆渲染大惊小怪,更不能以此推论江苏省下一步将全面封杀未通过评价的品种。
当然,也有一些朋友认为,难道省级政府不可以比国家政策更严?但问题是省级药监部门没有注销药品批文的权限啊!
关于采购3个通过仿制药的误读
此前,业界就很有一批人士看到采购政策中涉及“3个”字样时,不求甚解,误以为国家只需要通过一致性评价的前3个品种,后面未通过的品种就要退出市场。实际上,包括国家及省级采购部门的文件是“当有3个通过一致性评价品种后,不再采购未通过的仿制药”的规定,暂停采购后,只要能通过评价,照样能重返市场,当然,能不能中标,中标价格多少那是后话。
江苏仿制药一致性评价走在全国前列
不过,一码事归一码事,江苏不愧是医药强省,一致性评价工作走在全国前列,据《新华日报》报道,截至10月底,江苏省对口服固体制剂451个药品开展一致性评价,涉及93家企业254个品种,完成研究并获受理62个品规,数量居全国第一;获批16项,数量居全国第二。
一致性评价进展:已有6品规集满3家,19个基药通过一致性评价
据医药云端工作室统计,目前已有6个品规集满3家企业通过一致性评价,其中瑞舒伐他汀钙片已有4家,2018年底大限即将到来,尽管有些品种并不是289基药目录内的,但是抢占市场优势也是相当重要的,各企业都在和时间赛跑啊。
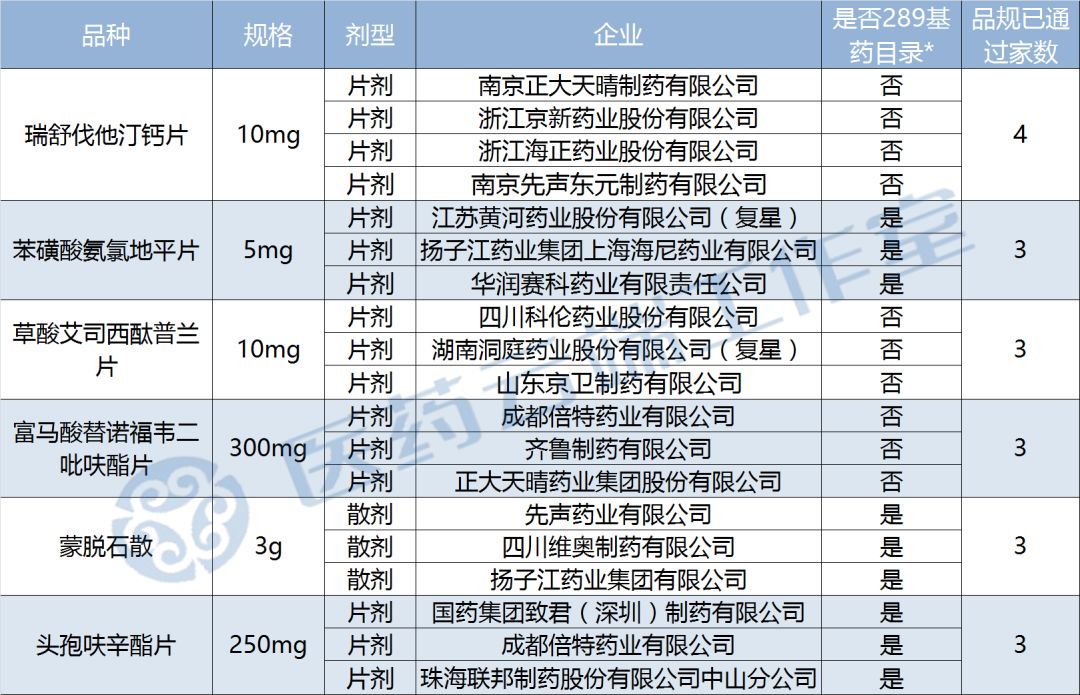
截至今日,医药云端工作室通过此前国家药监局公布的五批通过目录、企业公告以及上市目录集三个渠道统计,共105个品规通过(或视同通过)一致性评价,涉及品种共58个,其中属289目录的品种只有19个,完成度仅为6.57%。
信息来源:医药云端工作室 |