涉嫌“违反人类遗传资源管理规定”,华大、华山医院、药明康德等机构被处罚
日期:2018/10/25
【云端导读】
国家科技部发布六份行政处罚书,深圳华大基因、复旦大学附属华山医院、苏州药明康德、昆皓睿诚医药、厦门艾德生物以及阿斯利康六家企业被处罚,然而这些处罚书下发时间最早的是2015年,其次是2016年和2018年7月,为何今日才在官网上挂出?

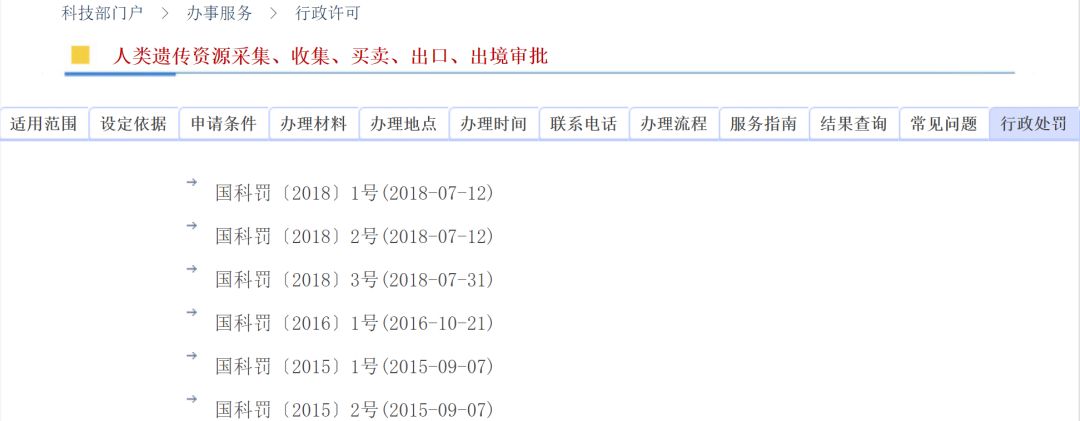
今日(10月24日),国家科技部发布六份行政处罚书,时间分别是2015年9月7日、2016年10月21日、2018年7月31日、2018年7月12日。令人不解的是,这些处罚书最早是三年前就已下发,为何今日才在官网上挂出?
什么是人类遗传资源管理规定?
老实说,小编也不知道这是个什么规定,于是带着好奇心搜索了一下国家科技部官网,发现了2016年3月7日的一篇报道:
我国系统全面的人类遗传资源管理始于1998年。这一年,第一个人类遗传资源管理的法规文件《人类遗传资源管理暂行办法》出台,对管理体制、国际合作和出境活动的审批程序做出了规定。人类遗传资源管理专家组成员甘荣兴认为,这填补了我国人类遗传资源管理的空白。
“此前,申办方发起的新药临床试验由国家药品监督管理部门来监管,主要监管内容是新药的安全性和有效性,对新药临床试验过程中涉及对受试者采样保护、人类遗传资源合理使用等方面的关注比较少。
研究者发起的药物临床研究没有国家相关部门来监管,对药物临床研究过程中涉及对受试者采样保护、人类遗传资源合理使用、完整的受试者知情同意、规范的伦理审批、知识产权分享和相关管理制度等方面的关注极少”甘荣兴说,彼时,人类遗传资源领域多头管理,分散无序。
但随着药物临床试验领域的国际合作日益紧密,人类遗传资源管理严重落后于国际通行规则与做法,制约了我国药物临床试验 GCP建设。
甘荣兴举例道,比方外方药企出资资助国内研究者发起的药物临床研究,所有的知识产权都归外方药企,而美欧国家的通行做法是根据实际贡献情况由研究者独享或与外方药企分享知识产权;
再比如,有些单位将新药临床试验剩余的样本、或者有意在新药临床试验过程中多采集受试者的样本在知情同意书内容和伦理批准的范围之外挪作他用,等等。
“我觉得这些年人类资源管理工作的实施对新药研发临床试验相关人员理念上的更新起了重要的推动作用。”北京大学第三医院药物临床试验机构主任李海燕说。
她坦陈,此前很多人并未意识到人类遗传资源管理在新药临床试验中的重要性。但近年来,随着人类遗传资源管理的不断推进,特别是去年10月份后,科技部组织了大规模的培训,大家对人类遗传资源的合理利用和保护的意识越来越强。
“各研究单位的伦理委员会及相关临床试验管理机构在受试者的知情同意、合作单位的知识产权分享、样品出境等各方面都逐步建立了涉及人类遗传资源管理的相关规范。”李海燕说。
通过实施人类遗传资源行政许可管理工作特别是建立“一纵一横一支撑”管理机制以来,政府各管理部门的权责更明确、流程更清楚、衔接更顺畅、监管更到位,不会出现重复多头管理的情况,申报单位对申报、批准和办理人类遗传资源出境的相关流程和手续更清晰,使人类遗传资源出境更顺畅。
甘荣兴具体阐述道,人类遗传资源管理的行政审批通过对国际合作开展药物临床试验过程中涉及人类遗传资源使用的关键环节的审核,如知情同意书的完整性、受试者签署知情同意书,医学伦理委员会的组建、制度建设、规范审批,在知情同意书中明确和伦理批准的范围内合理使用人类遗传资源种类、数量和生物安全,中外合作双方权利义务和知识产权分享通过合作协议明确,申报单位有关人类遗传资源管理的相关管理制度,相关项目执行的材料完整、可溯源和归档等方面,使国际合作项目执行不断规范,相关制度不断建立健全,知情同意和伦理审批比较规范,人类遗传资源更合理使用。
规范的人类遗传资源管理促进了我国临床药物试验 GCP的建设。例如,北京大学第一附属医院通过参加23项国际多中心临床药物研究合作,不仅促进这些药物在我国的上市,而且在试验中积累了国外原研药临床研发的经验,改善了临床试验硬件条件,规范了操作,完善了管理体系,培养了团队,逐渐成为国内领先,具有国际水平的临床 GCP基地。
针对MAH,优化人类遗传资源行政审批流程

而2017年10月26日,国家科技部又发布通知,科技部研究制定了针对为获得相关药品和医疗器械在我国上市许可,利用我国人类遗传资源开展国际合作临床试验的优化审批流程。
新的审批流程中优化的内容主要包括鼓励多中心临床研究设立组长单位,一次性申报;临床试验成员单位认可组长单位的伦理审查结论,不再重复审查;具有法人资格的合作双方共同申请;
调整提交伦理审查批件、食品药品监管总局出具的临床试验批件的时间,由原来的在线预申报时提交延后至正式受理时提交;取消省级科技行政部门或国务院有关部门科技主管单位盖章环节等方面。该审批流程自2017年12月1日起施行。
人类遗传资源审批不是新药开发的限速因素
在2017年9月26日的DIA中国第三届药物研究创新大会上,来自国家科技部社会发展科技司医药处官员做了“国家科技创新规划的重要举措及人类遗传资源管理相关法规制定”的演讲。
目前科技部在人类遗传资源上的管理体制,以及为了简化流程,加快审批所采取的多种方式。科技部为优化审批流程所做的不懈努力,包括建立组长申报制,方案为申请主体,合作各方共同申报,并行审查以及“一站式”受理等多种方式。这些改革措施对《暂行办法》的一些流程进行优化,
此外,遗传办还对申请书进行优化,比如将申请表格化等,大大减轻了申办方的填报负担,为企业创新助力。从目前审批情况及优化后的流程来看,人类遗传资源审批并不构成新药开发的明显限速因素。
以下是处罚书详细内容:
行政处罚决定书
国科罚〔2015〕2号
单位名称:深圳华大基因科技服务有限公司
地 址:广东省深圳市盐田区北山工业区综合楼
法定代表人:刘娜
根据《人类遗传资源管理暂行办法》(国办发〔1998〕36号)、《中华人民共和国行政处罚法》等有关规定,中国人类遗传资源管理办公室(以下简称遗传办)对深圳华大基因科技服务有限公司(以下简称华大科技)执行“中国女性单相抑郁症的大样本病例对照研究”国际科研合作情况进行了调查,现已调查终结。经查明,存在以下违法违规行为:
华大科技与华山医院未经许可与英国牛津大学开展中国人类遗传资源国际合作研究,华大科技未经许可将部分人类遗传资源信息从网上传递出境。
上述行为违反了《人类遗传资源管理暂行办法》第四条、第十一条、第十六条规定。现根据《人类遗传资源管理暂行办法》第二十一条及《中华人民共和国行政处罚法》有关规定,决定处罚如下:
1.你单位应于接到本决定书之日起立即停止该研究工作的执行。
2.销毁该研究工作中所有未出境的遗传资源材料及相关研究数据。
3.自本决定书送达之日起停止华大科技涉及我国人类遗传资源的国际合作,整改验收合格后,再行开展。
你单位如不服本处罚决定,可在收到本行政处罚决定书之日起60日内向科技部申请行政复议,也可以在6个月内向有管辖权的人民法院提起行政诉讼。复议和诉讼期间本决定不停止执行。逾期不履行本决定的,本处罚机关将申请人民法院强制执行。
中华人民共和国科学技术部
2015年9月7日
行政处罚决定书
国科罚〔2015〕1号
单位名称:复旦大学附属华山医院
地 址:上海乌鲁木齐中路12号
法定代表人:丁强
根据《人类遗传资源管理暂行办法》(国办发〔1998〕36号)、《中华人民共和国行政处罚法》等有关规定,中国人类遗传资源管理办公室(以下简称遗传办)对复旦大学附属华山医院(以下简称华山医院)开展的“中国女性单相抑郁症的大样本病例对照研究”国际科研合作情况进行了调查,现已调查终结。经查明,存在以下违法违规行为:
华山医院与深圳华大基因科技服务有限公司未经许可与英国牛津大学开展中国人类遗传资源国际合作研究,华山医院未经许可将部分人类遗传资源信息从网上传递出境。
上述行为违反了《人类遗传资源管理暂行办法》第四条、第十一条、第十六条规定。现根据《人类遗传资源管理暂行办法》第二十一条及《中华人民共和国行政处罚法》有关规定,决定处罚如下:
1.你单位应于接到本决定书之日起立即停止该研究工作的执行。
2.销毁该研究工作中所有未出境的遗传资源材料及相关研究数据。
3.自本决定书送达之日起停止华山医院涉及我国人类遗传资源的国际合作,整改验收合格后,再行开展。
你单位如不服本处罚决定,可在收到本行政处罚决定书之日起60日内向科技部申请行政复议,也可以在6个月内向有管辖权的人民法院提起行政诉讼。复议和诉讼期间本决定不停止执行。逾期不履行本决定的,本处罚机关将申请人民法院强制执行。
中华人民共和国科学技术部
2015年9月7日
行政处罚决定书
国科罚〔2016〕1号
单位名称:苏州药明康德新药开发股份有限公司
地 址:苏州市吴中区吴中大道1318号
法定代表人:李革
根据《人类遗传资源管理暂行办法》(国办发〔1998〕36号)、《中华人民共和国行政处罚法》等有关规定,中国人类遗传资源管理办公室对苏州药明康德新药开发股份有限公司(以下简称苏州药明康德公司)涉嫌违反人类遗传资源管理规定一案进行调查,现已调查终结。经查明,存在以下违法违规行为:
苏州药明康德公司未经许可将5165份人类遗传资源(人血清)作为犬血浆违规出境。
上述行为违反了《人类遗传资源管理暂行办法》第四条、第十六条规定。现根据《人类遗传资源管理暂行办法》第二十一条及《中华人民共和国行政处罚法》有关规定,决定处罚如下:
1.对苏州药明康德公司进行警告。
2.没收并销毁该项目中人类遗传资源材料。
3.自本决定书送达之日起,科技部暂停受理苏州药明康德公司涉及我国人类遗传资源的国际合作和出境活动的申请,整改验收合格后,再予以恢复。
根据《中华人民共和国行政处罚法》第三十二条规定,你单位如不服本处罚决定,可在收到本行政处罚决定书之日起60日内向科技部申请行政复议,也可在6个月内向有管辖权的人民法院提起行政诉讼。复议和诉讼期间本决定不停止执行。逾期不履行本决定的,本处罚机关将申请人民法院强制执行。
中华人民共和国科学技术部
2016年10月21日
行政处罚决定书
国科罚〔2018〕3号
单位名称:昆皓睿诚医药研发(北京)有限公司
地 址:北京经济技术开发区凉水河二街8号院15号楼302
法定代表人:张艳
根据《人类遗传资源管理暂行办法》(国办发〔1998〕36号)、《中华人民共和国行政处罚法》等有关规定,中国人类遗传资源管理办公室对昆皓睿诚医药研发(北京)有限公司(以下简称“昆皓睿诚”)违反人类遗传资源管理规定一案进行调查,现已调查终结。经查明,存在以下违法违规行为:
昆皓睿诚未经许可接收阿斯利康投资(中国)有限公司567管样本并保藏。
上述行为违反了《人类遗传资源管理暂行办法》第四条和第十一条规定。根据《中华人民共和国行政处罚法》和《人类遗传资源管理暂行办法》有关规定,决定处罚如下:
1.对昆皓睿诚进行警告。
2.没收并销毁违规利用的人类遗传资源材料。
根据《中华人民共和国行政处罚法》第三十二条规定,你单位如不服本处罚决定,可在收到本处罚决定书之日起60日内向科技部申请行政复议,也可以在6个月内向有管辖权的人民法院提起行政诉讼。复议和诉讼期间本决定不停止执行。逾期不履行本决定的,本处罚机关将申请人民法院强制执行。
中华人民共和国科学技术部
2018年7月31日
行政处罚决定书
国科罚〔2018〕2号
单位名称:厦门艾德生物医药科技股份有限公司
地 址:厦门市海沧区鼎山路39号
法定代表人:LI-MOU ZHENG
根据《人类遗传资源管理暂行办法》(国办发〔1998〕36号)、《中华人民共和国行政处罚法》等有关规定,中国人类遗传资源管理办公室对厦门艾德生物医药科技股份有限公司(以下简称“厦门艾德”)违反人类遗传资源管理规定一案进行调查,现已调查终结。经查明,存在以下违法违规行为。
厦门艾德未经许可接收阿斯利康投资(中国)有限公司30管样本,拟用于试剂盒研发相关活动。
上述行为违反了《人类遗传资源管理暂行办法》第四条和第十一条规定。根据《中华人民共和国行政处罚法》和《人类遗传资源管理暂行办法》有关规定,决定处罚如下:
1.对厦门艾德进行警告。
2.没收并销毁违规利用的人类遗传资源材料。
根据《中华人民共和国行政处罚法》第三十二条规定,你单位如不服本处罚决定,可在收到本行政处罚决定书之日起60日内向科技部申请行政复议,也可在6个月内向有管辖权的人民法院提起行政诉讼。行政复议和行政诉讼期间本决定不停止执行。逾期不履行本决定的,本处罚机关将申请人民法院强制执行。
科 技 部
2018年7月12日
行政处罚决定书
国科罚〔2018〕1号
单位名称:阿斯利康投资(中国)有限公司
地 址:中国(上海)自由贸易试验区亮景路199号
法定代表人:冯佶
根据《人类遗传资源管理暂行办法》(国办发〔1998〕36号)、《中华人民共和国行政处罚法》等有关规定,中国人类遗传资源管理办公室对阿斯利康投资(中国)有限公司(以下简称“阿斯利康”)违反人类遗传资源管理规定一案进行调查,现已调查终结。经查明,存在以下违法违规行为。
阿斯利康未经许可将已获批项目的剩余样本转运至厦门艾德生物医药科技股份有限公司和昆皓睿诚医药研发(北京)有限公司,开展超出审批范围的科研活动。
上述行为违反了《人类遗传资源管理暂行办法》第四条和第十一条规定。现根据《人类遗传资源管理暂行办法》第二十二条和《中华人民共和国行政许可法》及《中华人民共和国行政处罚法》有关规定,决定处罚如下:
1.对阿斯利康进行警告。
2.没收并销毁违规利用的人类遗传资源材料。
3. 撤销国科遗办审字〔2015〕83号、〔2016〕837号两项行政许可。
4.自本决定书送达之日起停止受理阿斯利康涉及中国人类遗传资源国际合作活动申请,整改验收合格后,再进行受理。
根据《中华人民共和国行政处罚法》第三十二条规定,你单位如不服本处罚决定,可在收到本行政处罚决定书之日起60日内向科技部申请行政复议,也可在6个月内向有管辖权的人民法院提起行政诉讼。行政复议和行政诉讼期间本决定不停止执行。逾期不履行本决定的,本处罚机关将申请人民法院强制执行。
科 技 部
2018年7月12日
信息来源:医药云端工作室 |