分级管理后,抗肿瘤药竞争格局要变
日期:2018/10/23
【云端导读】
国家卫健委发布《新型抗肿瘤药物临床应用指导原则(2018年版)》,其中所涉及的32种药物中,17种必须进行靶点检测,共涉及12个靶点。这一方面从官方层面禁止了靶向药物的滥用,另一方面也为临床诊断,特别是分子诊断领域带来了机会。
9月21日,国家卫生健康委医政医管局公开发布了《新型抗肿瘤药物临床应用指导原则(2018年版)》(以下称“指导原则”),以国家机构的层面对抗肿瘤药物的临床应用提供了官方的指导意见。
随着我国癌症发病人数的增加和新药开发上的突破,肿瘤创新药成为各家药企的开发热点,也是投资方的重点关注的领域之一。在此背景下,国家卫健委以官方身份公布的临床药物指导原则,对未来肿瘤药物的开发和应用有着指导意义。
合理应用受到重视,为基因检测带来机会
根据《指导原则》,抗肿瘤药物是否合理,基于两个方面:有无应用指征;选用品种及给药方案是否适宜。
在应用指征上,《指导原则》明确指出,靶向药物必须经过国家药品监管部门批准的基因检测后方可使用,不得在未做相关检查的情况下盲目用药。《指导原则》明确列出必须进行基因检测的药物以及所需检测的项目(表1)。
表1:所列基因检测项目及需要检测靶点的药物
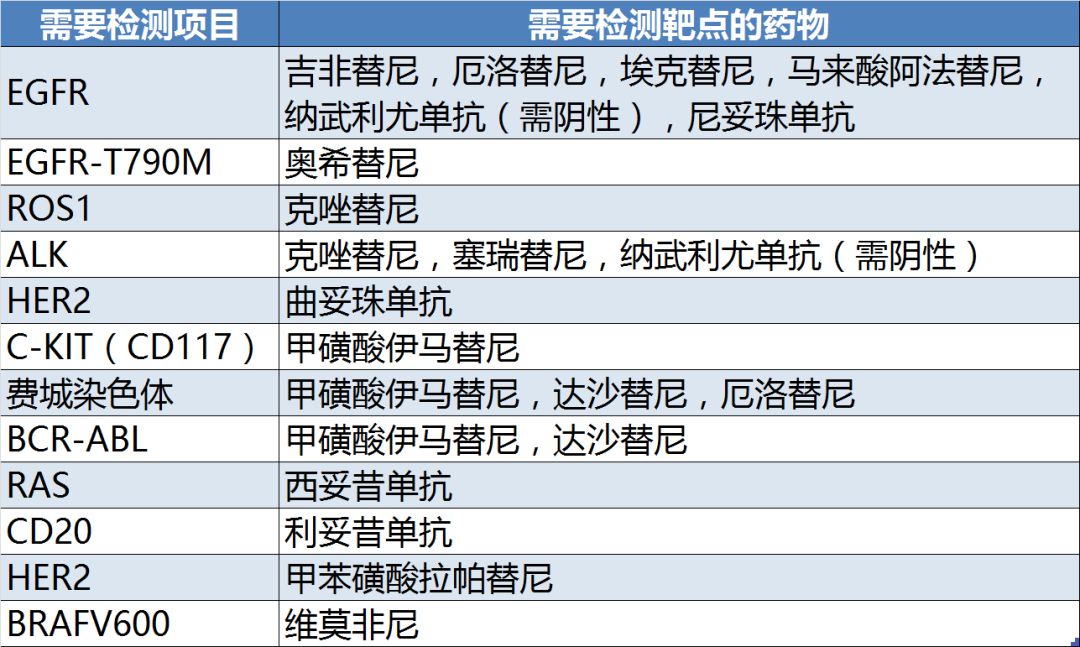
《指导原则》所涉及的32种药物中,17种必须进行靶点检测,共涉及12个靶点。这一方面从官方层面禁止了靶向药物的滥用,另一方面也为临床诊断,特别是分子诊断领域带来了机会。随着越来越多的靶向药的上市,对伴随诊断产品的需求相信也会随之增加。
严格按适应症用药的同时,及时采纳最新用法
《指导原则》指出,肿瘤药物的临床应用必须遵循说明书,不能随意超适应症使用。但另一方面,文件中也提及,随着治疗临床实践的快速发展,药品说明书往往滞后于临床实践,因此允许特殊情况下的超适应症使用。
特殊情况下抗肿瘤药物的使用仅限于三级医院授权的具有高级专业技术职称的医师,采纳根据依次是:其他国家或地区药品说明书中已注明的用法,国际权威学协会或组织发布的诊疗规范、指南,国家级学协会发布的经国家卫生健康委员会认可的诊疗规范、指南。
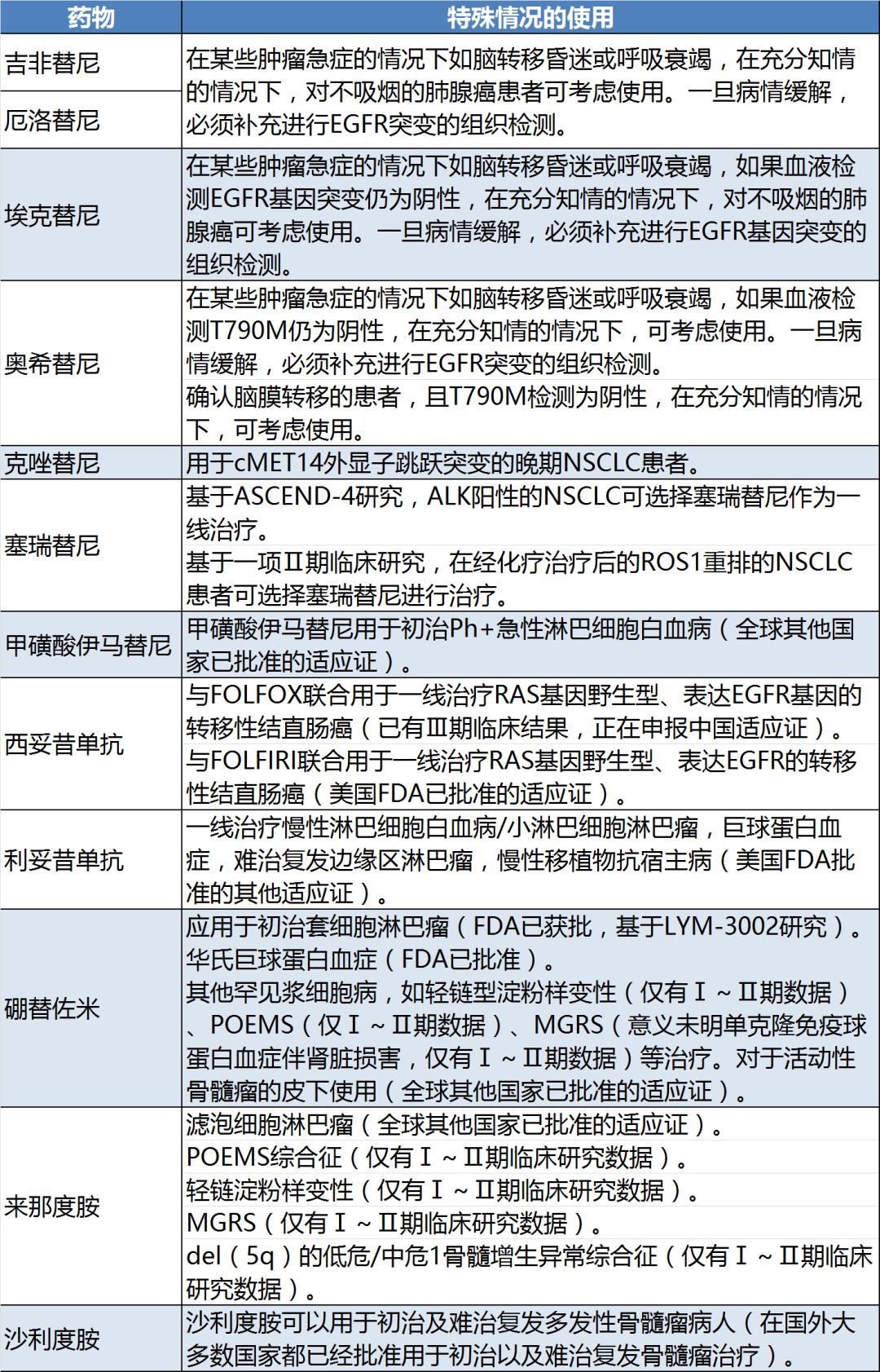
此次《指导原则》所涉及的33种药物中,有12个药物列明了特殊情况下的超适应症使用(表2)。特别值得一提的是,沙利度胺的说明书适应症仅为麻风病,并不是抗肿瘤药物,但被作为抗肿瘤药物列入《指导原则》,用于初治及难治复发多发性骨髓瘤。 这一举措说明,在严格用药管理的同时,卫健委正积极与国际最新研究接轨,推动国外已获批的适应症在国内的应用。
表2:《指导原则》中提及的特殊情况使用
分级管理,国家谈判品种重要性凸显
《指导原则》首次提出了抗肿瘤药物临床应用的分级管理。文件指出,在临床应用中,应当优先选择药物经济学评价和效价比高的药品。根据药物适应证、药物可及性和肿瘤治疗价值,将抗肿瘤药物分成两级(见表3)。
表3:《指导原则》抗肿瘤药物使用分级

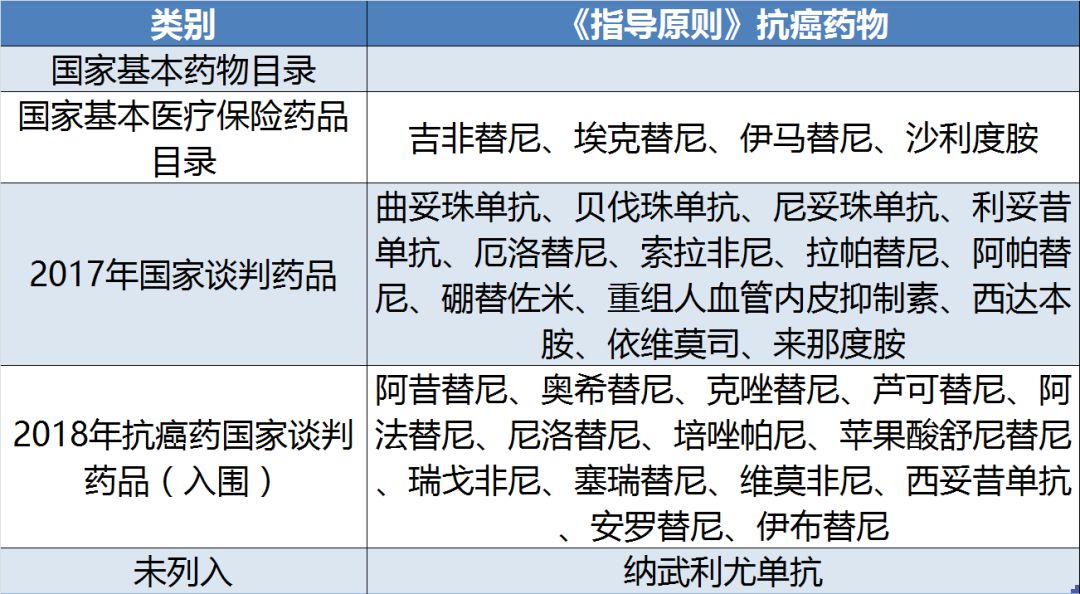
有意思的是,分类标准是根据药物是否进入三个与医保支付密切相关的药物目录来考量的,并且绝大多数为2017年国家谈判药品和2018年抗癌药国家谈判入围品种(见表4)。唯一未列入药物目录的品种是今年6月刚获得批准的创新机制首个PD-1抑制剂纳武利尤单抗。
2017年国家谈判药品中15个非中药抗肿瘤药物中,除阿比特龙和氟维司群以外,均进入《指导原则》。而2018年国家抗癌药专项谈判入围的18个药物中,仅4个药物:枸缘酸伊沙佐米、培门冬酶、阿扎胞苷和醋酸奥曲肽微球4个药物未列入《指导原则》。由此可见,国家谈判药物的药物经济学价值和性价比受到国家卫健委的肯定。通过国家谈判获得医保支付的品种有望在临床获得优先使用。
表4:《指导原则》药物列入国家目录情况
大多数产品是仿制热点,多家公司竞相研发
笔者梳理了本次《指导原则》所涉及的32个抗肿瘤新药,发现这些药物都是开发热点,虽然目前大多还处在临床开发阶段,但预期未来产品纷纷上市后,市场竞争会非常激烈。
除了6个国内企业开发的原研药外,大多数品种已有公司正在研发仿制药(或生物类似药),其中吉非替尼、伊马替尼、达沙替尼、硼替佐米和来那度胺已有国产仿制药上市(表5)。
表5:《指导原则》新型抗肿瘤药物竞争态势
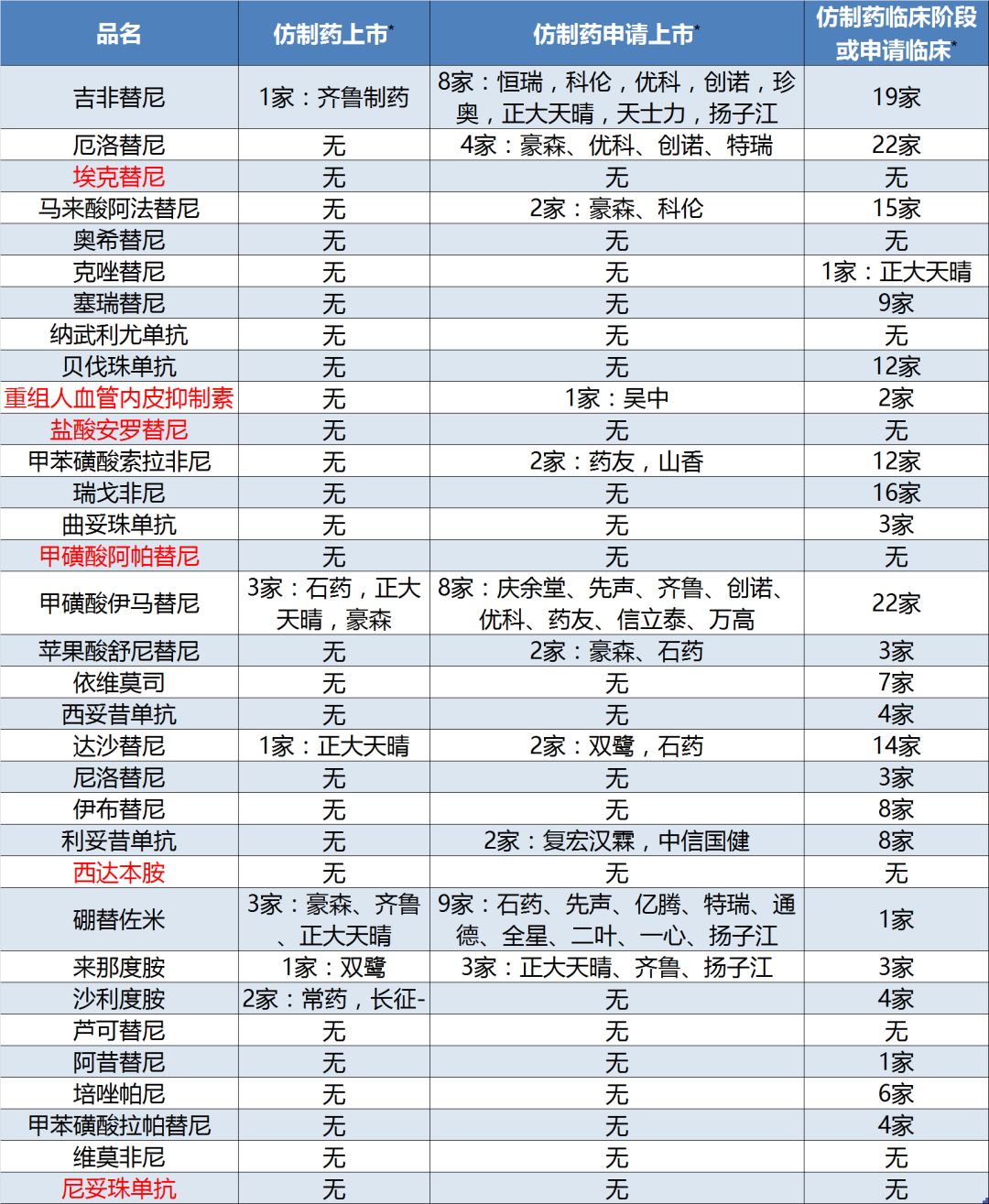
注:1、仿制药,包括大分子药物的生物类似药;2、标红为国产药企原研产品
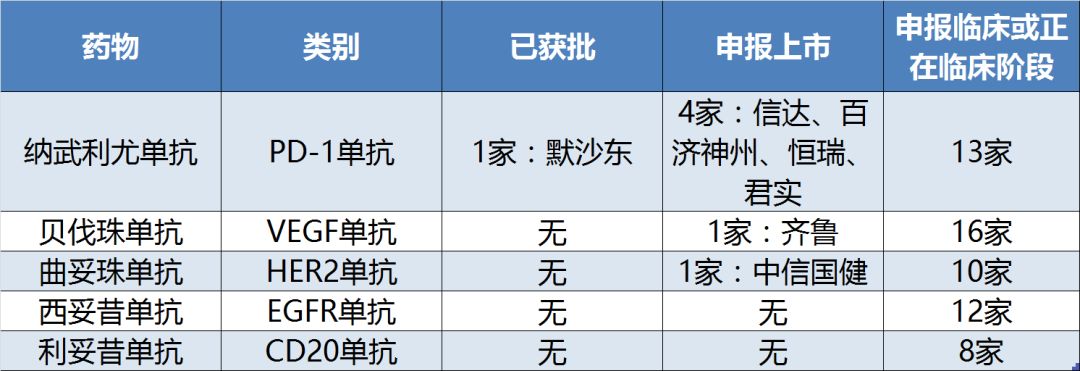
对于其中的大分子单抗药物而言,一些靶点,如PD-1、VEGF、HER2、EGFR和CD20也是当仁不让的开发热点,绝大多数有超过10家公司正在积极开发针对该靶点的产品(表6)。
表6:《指导原则》部分热门靶点的单抗药物
|